Ваксината на Pfizer напълно одобрена – какво означава това?
Ваксината на Pfizer напълно одобрена – какво означава това?
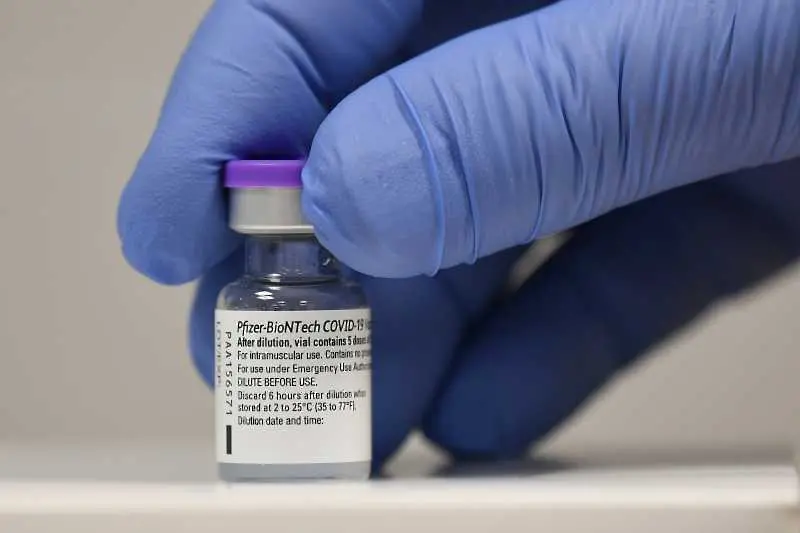
Ваксината, с която започна масовото имунизиране срещу COVID-19 в света – тази на Pfizer/BioNTech, получи ново и още по-безусловно потвърждение на двата най-важни показателя – безопасност и ефикасност, след като американският регулаторен орган, Американската агенция по храните и лекарствата FDA, излезе с решение за пълното ѝ одобрение.
Според изявлението на агенцията тя ще е достъпна под марката Comirnaty за превенция на коронавирусна инфекция при лица на и над 16 години, като в същото време остава спешното разрешение за ползване при деца на възраст между 12 и 15 години, както и за прилагане на бустерна доза в допълнение към задължителните две.
Към момента броят на напълно ваксинираните в САЩ надвишава 91 млн. души според Центъра за контрол и превенция на заболяванията (CDC). Новият ход на властите има потенциала да мотивира още хора да се отправят към центровете за имунизация.
Какъв обаче беше статутът на ваксината на Pfizer от 11 декември досега и какво влагат експертите в термините „спешно разрешение“ и „пълно одобрение“? Даваме отговори в следващите редове.
Какво означава пълно одобрение на ваксина?
Според Лиса Марагакис и Гейбър Келън от института „Джонс Хопкинс“ към пълно одобрение FDA преминава тогава, когато има достатъчно налични данни, демонстриращи, че ваксините са безопасни и ефективни за повечето хора, получили дози от тях. През последните месеци агенцията е натрупала достатъчно информация, вземайки предвид факта, че препаратът на Pfizer и BioNTech се прилага в 115 държави според интерактивна статистика на вестник „Ню Йорк Таймс“.
[[{"fid":"379103","view_mode":"default","fields":{"format":"default","alignment":"","field_file_image_alt_text[und][0][value]":false,"field_file_image_title_text[und][0][value]":false},"link_text":null,"type":"media","field_deltas":{"1":{"format":"default","alignment":"","field_file_image_alt_text[und][0][value]":false,"field_file_image_title_text[und][0][value]":false}},"attributes":{"height":3599,"width":5354,"class":"media-element file-default","data-delta":"1"}}]]
13-годишната Амя получава ваксина срещу COVID-19 в Луизиана. /Getty Images
Един от първите източници на информация за имунизацията с ваксината бе кампанията по масовото ѝ прилагане в Израел, където над 60% от населението вече е напълно имунизирано. Страната може да се окаже ключова и за данните по отношение на третата бустерна доза от ваксината, след като през юли предложи на лицата над 60-годишна възраст възможността да си поставят от нея.
В продължение на повече от век ваксините, одобрявани от FDA, предотвратяват потенциално сериозни заболявания като морбили, грип и магарешка кашлица. Имунизациите са помогнали за намаляване и предотвратяване на смъртоносни огнища шарка и полиомиелит.
Системата за одобрение на една ваксина използва научни данни и строги стандарти. Процесът включва:
Клинични тестове. FDA изисква строго изпитване на ваксините чрез поредица от изпитвания, за да се увери, че те работят добре и са безопасни, преди да ги разреши или одобри за масово ползване. Лабораториите, които провеждат изследванията, са независими от компаниите за ваксини и правителството.
Рискове и ползи. FDA оценява рисковете и ползите от анализирания препарат. Преди да се стигне до одобрение, клиничните тестове и други данни, използвани от агенцията, трябва да демонстрират, че ползите от ваксината са по-големи от рисковете за онези, които ще бъдат ваксинирани.
Продължителен мониторинг. Разглеждането на една ваксина не приключва с разрешението за нейното ползване. FDA продължава да събира данни, но те вече са съсредоточени върху хората, получили ваксината. Ако бъдат открити проблеми, агенцията може да постави на пауза администрирането на ваксината, за да бъдат проведени още проучвания и да се гарантира, че предимствата продължават да са повече, отколкото проблемите.
Насоки за производство. Това, което задължително прави FDA, е да заложи стриктни условия на производителите на ваксините, както и да изиска тестване на дозите от ваксината по партиди, за да бъдат гарантирани качеството и ефективността им, както и това, че тези два фактора остават последователни и надеждни във времето.
Какви данни са използвани за издаването на решение за пълното одобрение на препарата на Pfizer-BioNTech?
От FDA съобщават, че са стигнали до решението чрез преглед на обновени данни от клиничните изпитания, което подкрепя спешното разрешение за употреба на ваксината и включва по-голяма продължителност на проследяване при по-голям брой хора.
Анализирана е информация за приблизително 20 хил. ваксини и 20 хил. плацебо получатели на възраст на и над 16 и повече години, които не са имали белези за инфектиране с COVID-19 в рамките на една седмица след получаване на втората доза. Безопасността на Comirnaty е оценена и на базата на неколкомесечно проследяване. Повече от половината от участниците в клиничното изпитване са следени в рамките на 4 месеца след втората доза. Близо 12 хил. души са следени в продължение на поне 6 месеца.
Най-често съобщаваните странични ефекти от участниците в тестването са болка, зачервяване и подуване на мястото на инжектиране, умора, главоболие, мускулни или ставни болки, втрисане и треска. Ваксината е доказано ефективна в предотвратяване на COVID-19 и потенциално сериозно последици, включително хоспитализация и смърт.
Два вида употреба: Спешно разрешение срещу пълно одобрение
Какво означават тези два процеса за една ваксина? Не всеки препарат получава позволение за спешна употреба преди пълното одобрение. Три ваксини срещу COVID-19 стигнаха до такова заради незабавната нужда от защита на хората от коронавирусната пандемия.
[[{"fid":"379104","view_mode":"default","fields":{"format":"default","alignment":"","field_file_image_alt_text[und][0][value]":false,"field_file_image_title_text[und][0][value]":false},"link_text":null,"type":"media","field_deltas":{"2":{"format":"default","alignment":"","field_file_image_alt_text[und][0][value]":false,"field_file_image_title_text[und][0][value]":false}},"attributes":{"height":3712,"width":5568,"class":"media-element file-default","data-delta":"2"}}]]
Ваксините на AstraZeneca (в жълто), на Moderna (в червено) и на Pfizer (в зелено). /Getty Images
От „Джонс Хопкинс“ посочват, че когато през 2020 г. става ясно, че COVID-19 е опасна и бързо разпространяваща се болест, FDA започва работа с производители на ваксини, независими лаборатории, академични изследователски центрове и неправителствени учреждения, за да събере по-бързо големи количества информация за ваксините. Оттам става ясно, че препаратите са ефикасни и че рисковете за сериозни странични ефекти са ниски. На базата на тези открития е дадено и спешното разрешение на AstraZeneca, Moderna и Pfizer.
Пълно одобрение се дава, когато с течение на времето FDA натрупа още повече научни доказателства в подкрепа на използването на ваксините, показващи, че ползите са повече от рисковете.
Накратко – до спешно разрешение се стига в кризисни ситуации и на базата на оскъдно количество данни. Пълното одобрение има по-голяма тежест, тъй като при него става дума за проследяване на ефекта на ваксината във времето, и то върху много по-широк кръг от хора, върху които е приложена. С този процес се отчита и по-високото доверие във възможностите на препарата.
Ключови думи
ОЩЕ ОТ КАТЕГОРИЯТА
|
|


















Коментари
Няма въведени кометари.